RESUMEN
Las infecciones fúngicas en el ser humano están relacionadas con la formación de biopelículas resistentes a tratamientos farmacológicos. El complejo de S. schenckii presenta micosis crónicas y sistémicas con resistencia farmacológica. Sin embargo, en S. schenckii no se ha descrito la formación de biopelículas; este aspecto se aborda en la presente investigación, analizando las características bioquímicas de la formación y desarrollo de las biopelículas, aplicando técnicas de microscopía óptica y métodos fisicoquímicos. Los resultados indican que la adhesión y desarrollo de la comunidad fúngica es tiempo dependiente (12 h, 24 h y 48 h); consecuentemente se presenta incremento de la biomasa (0.19 Abs - 0.5 Abs) y carbohidratos totales (1.12 µg/µl - 3.28 µg/µl). Estructuralmente, la adhesión y desarrollo de S. schenckii presenta redes de hifas con centros de nucleación que consolidan la biopelícula. La prospectiva del estudio de las biopelículas de S. schenckii impactará en las estrategias farmacológicas del tratamiento de las micosis.
ABSTRACT
Fungal infections of the human being are associated to the formation of biofilms, which are resistant to antifungal drug therapy. The complex of S. schenckii presents chronic and systemic mycoses with antifungal resistance. However, in S. schenckii the biofilm formation has not been described, this issue is addressed in the present research, analyzing the biochemical characteristics of the formation and development of biofilms, using optical microscopy and physicochemical methods. The results indicate that the adhesion and development of the fungal community is time dependent (12 h, 24 h and 48 h). The results indicate that the adhesion and development of the fungal community is time dependent (12 h, 24 h and 48 h), thereby increasing the biomass (0.19 Abs to 0.5 Abs) and total carbohydrates (1.12 μg/μl - 3.28 μg/μl) occurs. When adhesion and development takes place, S. schenckii has hyphae networks with nucleation centers that consolidate the biofilm structurally. Prospective study of biofilms of S. schenckii impact in the pharmacological treatment strategies of fungal infections.
INTRODUCCIÓN
Actualmente, las enfermedades infecciosas por las biopelículas fúngicas son de relevancia en la salud pública, sobre todo en pacientes inmunocomprometidos que actúan como reservorios de fuentes persistentes de la infección al estar asociados a dispositivos médicos implantables como prótesis, catéteres venosos, conectores, tubos endotraqueales, dispositivos intrauterinos, válvulas cardiacas, marcapasos, catéteres de diálisis, prótesis de cadera y lentes de contacto (Castrillón-Rivera, Palma-Ramos & Padilla-Desgarennes, 2010; Larocco, Dorenbaum, Robinson & Pickering, 1988).
Una biopelícula es una comunidad de microorganismos que pueden ser de una sola especie o de varias, embebidas en una matriz extracelular y adheridos a superficies bióticas o abióticas (Silva, et al., 2009). Se ha reportado que existen diferentes etapas para la formación de la biopelícula en tiempos dependientes. Una de las primeras etapas es la adhesión de las conidias o levaduras, seguido por una fase de filamentación celular y proliferación, consecuentemente la maduración que resulta en una red micelial embebida en la matriz polimérica extracelular constituida de exopolisacaridos (Al-Fattani & Douglas, 2006).
La importancia de las biopelículas en la salud pública se debe principalmente a que presentan resistencia a la farmacoterapia, contribuyendo al estado crónico de la enfermedad; por ejemplo, se han reportado enfermedades como endocarditis valvular, infecciones nosocomiales y fibrosis quística (neumonía), asociadas a las infecciones provenientes de biopelículas fúngicas del género Candida y Aspergillus (Castrillón-Rivera et al., 2010).
El Sporothrix schenckii, agente causal de la esporotricosis, micosis más frecuente descrita en Brasil, México, Cuba, India y Australia, es de relevancia clínica por las infecciones que provoca en pacientes inmunocomprometidos y neonatos, las infecciones intrahospitalarias por contaminación de dispositivos médicos, la resistencia farmacológica, el estado crónico de la enfermedad y la falta de prevención de la enfermedad mediante inmunización (López-Romero et al., 2011; Sandoval-Bernal et al., 2011). Estas características indican una potencial capacidad de S. schenckii para formar una biopelícula. Sin embargo, en S. schenckii no se ha descrito la formación de biopelículas, por ello este aspecto se aborda en la presente investigación, analizando las características bioquímicas de la formación y desarrollo de las biopelículas.
MATERIALES Y MÉTODOS
Cultivo de S. schenckii
Se utilizó la cepa MP102 de S. schenckii que fue donada por la Dra. Haydee Torres Guerrero (Departamento de Parasitología y Microbiología, Facultad de Medicina, UNAM).
Para generar conidias de S. schenckii se utilizó el medio Yeast Peptone Glucose (YPG) (extracto de levadura 0.3%, peptona de gelatina 1%, glucosa 2%, agar 2%), a pH 4.5 incubando a 28 ºC (Bartnicki-García & Nickerson, 1962). Posteriormente, se recuperon las conidias y se almacenan a -20 ºC para la conservación y propagación del hongo.
Formación de biopelículas de S. schenckii
Se inocularon 2.4 conidias/ml × 106 conidias/ml en microplacas de seis pozos (Corning Costar) en medio YPG y se incubaron a 28 ºC. Después de 6 h se retiraron las conidias no adheridas y se prosiguió la incubación durante 12 h, 24 h y 48 h. Al término de este tiempo se retiró el medio y se lavó la biopelícula con solución amortiguadora de fosfatos (PBS) (Silva et al., 2009) y se efectuó el análisis de biomasa y carbohidratos totales que posteriormente se describen.
Análisis morfológico de las biopelículas de S. schenckii
Para este tipo de análisis, la formación de la biopelícula se realizó sobre cubreobjetos de plástico (Thermanox Plastic, USA), inoculando 2.4 conidias/ml × 106 conidias/ml de medio YPG, en microplacas de 12 pozos (Corning Costar), se incubaron a 28ºC durante 12 h, 24 h y 48 h. Las preparaciones se analizaron: i) al microscopio óptico invertido (TCM 400 Labomed, USA); ii) con microscopía de fluorescencia utilizando la sonda de blanco de Calcoflúor al 0.01% (Sigma) (Sabanero, Galindo, Barbosa-Sabanero, Sabanero & Torres-Guerrero, 2000). Las preparaciones se montaron con Vector (Vectashield) y se observaron al microscopio de epifluorescencia (ex: 450 nm - 490 nm, modelo DMLS Leica).
Determinación de la biomasa por el método de cristal violeta
Se determinó la cuantificación de la biomasa durante el desarrollo de la biopelícula en las preparaciones de 12 h, 24 h y 48 h, utilizando el método de cristal violeta 0.01% (Silva et al., 2009). Se definió la lectura a la absorbencia de 570 nm.
Determinación de carbohidratos totales por el método de Dubois
La cuantificación de carbohidratos totales durante el desarrollo de la biopelícula (12 h, 24 h y 48h) se determinó por el método de Dubois, Gilles, Hamilton, Rebers & Smith (1956). Brevemente, se tomó una alícuota de 200 μL de la biopelícula, se completa a 1mL con H2O destilada estéril; se adicionó 500 μL de solución de fenol 5% y 2.5 mL de ácido sulfúrico concentrado, se incubó a 30 ºC; después de 15 min se determinó la lectura de la absorbencia a 492 nm. En estos ensayos se utilizó una curva estándar de glucosa.
Análisis estadístico
El análisis estadístico se realizó mediante el programa Statistica 7. Se efectuó una prueba de normalidad, a los datos que siguieron una distribución normal, como el de carbohidratos totales, se aplicó un Modelo Lineal General (Factorial). Por otra parte, para los datos que no siguieron la distribución normal, como es el caso de la biomasa, se efectuó la prueba de comparación independiente múltiple (Kruskal-Wallis). Se efectuaron tres experimentos independientes con una n = 3 y un intervalo de confianza del 95%.
RESULTADOS
Morfología y desarrollo de la biopelícula de S. schenckii
La adhesión de las conidias al sustrato es el primer paso para la formación de las biopelículas (figura 1); el proceso de diferenciación de conidias a hifas inicia en esta etapa, se observan cuerpos fructíferos formando la característica flor, adosados al vástago de la hifa (figura 1A); durante la formación y el desarrollo de las biopelículas se efectúan procesos de secreción de componentes extracelulares que forman la matriz constituida principalmente de carbohidratos, que sirven como soporte para las hifas que van a constituir la biopelícula (figura 1B). Finalmente se observa la maduración de la biopelícula (figura 1C), en cuya estructura son evidentes las redes de hifas que se adhieren entre ellas y consolidan la biopelícula.
|
| |
 |
| |
Figura 1. Micrografías del desarrollo y formación de las biopelículas de S. schenckii. A) adhesión y diferenciación de conidias a hifas; B) desarrollo y formación de la biopelícula a 24 h; C) biopelícula madura (48 h) constituida por redes de hifas.
Fuente: Elaboración propia. |
 |
Figura 1. Micrografías del desarrollo y formación de las biopelículas de S. schenckii. A) adhesión y diferenciación de conidias a hifas; B) desarrollo y formación de la biopelícula a 24 h; C) biopelícula madura (48 h) constituida por redes de hifas.
Fuente: Elaboración propia. Close |
Características bioquímicas de la biopelícula de S. schenckii
La cuantificación de la biomasa refleja el desarrollo de la biopelícula que se determinó por métodos colorimétricos (figura 2A). Los resultados de la cinética de crecimiento durante 12 h - 48 h muestran cuantitativamente que la biomasa de la biopelícula incrementó con respecto al tiempo (figura 2B). Los resultados de la morfología y el desarrollo de la biopelícula (biomasa) indican que la formación íntegra de la biopelícula se presenta a las 48 h bajo las condiciones utilizadas en el presente estudio.
|
| |
 |
 |
| |
Figura 2. Cinética de formación y desarrollo de la biopelícula de S. schenckii. a)desarrollo y formación de la biopelícula teñida con cristal violeta; b)cuantificación de la biomasa. Las letras representan diferencias estadísticamente significativas. p < 0.05 n = 3 de tres experimentos independientes por triplicado usando Kruskal-Wallis.
Fuente: Elaboración propia. |
 |
 |
Figura 2. Cinética de formación y desarrollo de la biopelícula de S. schenckii. a)desarrollo y formación de la biopelícula teñida con cristal violeta; b)cuantificación de la biomasa. Las letras representan diferencias estadísticamente significativas. p < 0.05 n = 3 de tres experimentos independientes por triplicado usando Kruskal-Wallis.
Fuente: Elaboración propia. Close |
Por otra parte, los resultados de la tinción de componentes de la pared celular con sondas fluorescentes, tales como el blanco de Calcofluor, indican la presencia de quitina en la pared celular (figura 3); durante el desarrollo y la formación de la biopelícula muestra una clara fluorescencia que delinea la morfología de las estructuras que constituyen las biopelículas.
|
| |
 |
| |
Figura 3. Micrografías del desarrollo y formación de las biopelículas de S. schenckii. A) adhesión y diferenciación de conidias a hifas; B) desarrollo y formación de la biopelícula a 24 h; C) biopelícula madura (48 h) constituida por redes de hifas.
Fuente: Elaboración propia. |
 |
Figura 3. Micrografías del desarrollo y formación de las biopelículas de S. schenckii. A) adhesión y diferenciación de conidias a hifas; B) desarrollo y formación de la biopelícula a 24 h; C) biopelícula madura (48 h) constituida por redes de hifas.
Fuente: Elaboración propia. Close |
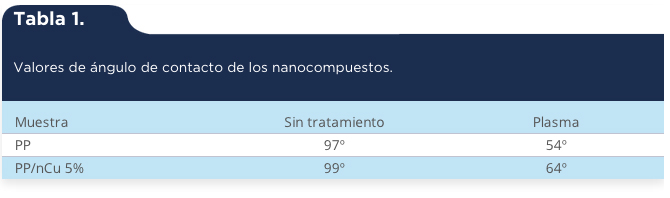
Además, durante el desarrollo de la biopelícula de S. schenkii se determinó el contenido total de carbohidratos, como azúcares simples, oligosacáridos y polisacáridos. Los resultados indican que los carbohidratos totales presentes en la biopelícula muestran un incremento con respecto al tiempo (tabla 1).
Tabla 1.
Determinación de carbohidratos totales a diferentes tiempos de la biopelícula de S. schenckii. p < 0.05 n = 3 de tres experimentos independientes por triplicado usando factorial de medias.
|
|
Tiempo (h)
|
Carbohidratos totales (µg/µl)
|
|
12
|
1.1271 ± 0.200
|
|
24
|
2.1829 ± 0.124
|
|
48
|
3.2883 ± 0,094
|
Fuente: Elaboración propia.
Abrir
 |
Fuente: Elaboración propia. Close |
DISCUSIÓN
Un gran número de infecciones fúngicas son relacionadas con la formación de la biopelícula sobre las superficies biológicas, las cuales son recalcitrantes a los tratamientos antifúngicos y causan mortalidad (Al-Fattani & Douglas, 2006).
El presente trabajo de investigación provee información esencial sobre la formación y desarrollo de biopelículas de S. schenckii. Éste es el primer estudio sobre la formación de biopelículas en este hongo patógeno, no obstante nuestros resultados indican que existen similitudes con lo encontrado en otros hongos, tales como Candida, Malassezia, Cryptococcus (Ajesh & Sreejith, 2012; Al-Fattani & Douglas, 2006), particularmente la adherencia, como primer paso de formación de las biopelículas. Éste es un proceso complejo, regulado por diversas características del medio de cultivo, la superficie del sustrato y muy importantemente la especie de los microorganismos. En el presente trabajo se usaron sustratos abióticos, tales como placas de poliestireno, observando el desarrollo y la formación de la biopelícula fúngica.
La estructura de la biopelícula de S. schenckii es muy simétrica y organizada en múltiples monocapas de hifas con producción de matriz extracelular, la cual está constituida de carbohidratos totales que se incrementan durante las diferentes fases del desarrollo, de manera similar se incrementa la señal de la sonda fluorescente de Calcofluor que se une a N-acetilglucosamina, componente de la quitina que constituye la pared celular del hongo, indicando que el proceso de síntesis y secreción (Navarro, Eisman, Román & Pla, 2001) de la comunidad fúngica se optimiza para consolidar la arquitectura filamentosa de la biopelícula.
En contraste con la estructura de las biopelículas formadas por Candida y otros hongos que muestran conidias, levaduras e hifas (Silva et al., 2009), S. schenckii presenta una biopelícula simétrica y ordenada constituida principalmente de redes de hifas, indicando que la formación es especie específica.
Se ha reportado que las infecciones por S. schenckii son difíciles de erradicar y que las terapias convencionales son inefectivas; esto puede ser debido a su capacidad de formar biopelículas como las descritas en este trabajo. En conclusión, los resultados indican que S. schenckii es capaz de formar biopelículas, indicando que la formación de estas estructuras no está restringida a ningún grupo específico de microorganismos y se puede considerar que bajo condiciones adecuadas son capaces de formar biopelículas que presentan resistencia a los tratamientos antifúngicos. Este aspecto está actualmente bajo investigación en nuestro laboratorio.
AGRADECIMIENTOS
Este trabajo fue apoyado por la Universidad de Guanajuato y por el Consejo Nacional de Ciencia y Tecnología (Conacyt), proyecto Ref. 157577 a MSL.
REFERENCES
Ajesh, K. & Sreejith, K. (2012). Cryptococcus laurentii biofilms: Structure, development and antifungal drug resistance. Mycopathologia, 174(5-6), 409-419.
Al-Fattani, M. & Douglas, J. (2006). Biofilm matrix of Candida albicans and Candida tropicalis: chemical composition and role in drug resistance. Journal of Medical Microbiology, 55(8), 999-1008.
Bartnicki-Garcia, S. & Nickerson, W. J. (1962). Induction of yeast-like development in Mucor by carbon dioxide. Journal of Bacteriology, 84(1), 829-840.
Castrillón-Rivera, L. E., Palma-Ramos, A. & Padilla-Desgarennes, M. C. (2010). Importancia de las biopelículas en la práctica médica. Dermatología. Revista Mexicana, 54(1), 14-24.
Dubois, M., Gilles, K. A., Hamilton, J. K., Rebers, P. A. & Smith, F. (1956). Colorimetric method for determination of sugars and related substances. Analytical Chemistry, 28(3), 350-356.
Larocco, M., Dorenbaum, A., Robinson, A. & Pickering, L. K. (1988). Recovery of Malassezia pachydermatis from eight infants in a nenonatal intensive care nursery: clinical and laboratory features. Pediatric Infectious Disease Journal, 7(6), 398-401.
López-Romero, E., Reyes-Montes, M. R., Pérez-Torres, A., Ruiz-Baca, E., Villagómez-Castro, J. C., Mora-Montes, H., Flores-Carreón, A. & Toriello, C. (2011). Sporothrix schencki complex and sporotrichosis, an emerging health problem. Future Microbiology, 6(1), 85-102.
Navarro, F., Eisman, B., Román, E. & Pla, J. (2001) Signal transduction pathways and cell-wall construction in Candida albicans. Medical Mycology, 39(1), 87-100.
Sabanero, M., Galindo, G., Barbosa-Sabanero, G., Sabanero, G., & Torres-Guerrero, H. (2000). Un nuevo enfoque en el estudio de la Esporotricosis: mutantes de Sporothrix schenckii. Acta Universitaria, 10(1), 3-9.
Sandoval-Bernal, G., Barbosa-Sabanero, G., Shibayama, M., Pérez-Torres, A., Tsutsumi, V. & Sabanero, M. (2011). Cell wall glycoproteins participate in the adhesión of Sporothrix schenckiito epithelial cells. Mycopathologia,171(4), 251-259.
Silva, S., Henriques, M., Martins, A., Oliveira, R., Williams, D. & Azeredo, J. (2009). Biofilm of non-Candida albicans Candida species: quantification, structure and matrix composition. Medical Mycology, 47(7), 681-689.